Cet article est basé sur des informations générées par RegGenius, RegASK IA-conduit outil de veille réglementaire.
Dans Avril 2023Le Danemark est devenu le premier pays européen à interdire officiellement l'ashwagandha, exigeant immédiatement le retrait des rayons de tous les produits contenant cette plante adaptogène populaire. Il ne s'agissait pas d'une simple mise à jour réglementaire de routine. En quelques mois, ce qui était au départ une décision d'un seul pays allait déclencher un effet domino dans tout le pays. Europe, obligeant les entreprises de compléments alimentaires à repenser complètement leurs stratégies.
Entre 2023 et 2025, les autorités se sont concentrées non seulement sur l'ashwagandha, mais aussi sur le kratom, le Tongkat Ali et les extraits de thé vert, reflétant des préoccupations accrues en matière de sécurité et des normes de protection des consommateurs plus strictes. Pour les entreprises qui se sont développées dans le domaine des plantes adaptogènes [1] et les plantes traditionnelles, comprendre ces changements réglementaires n'est pas seulement une question de veille économique ; c'est une stratégie de survie.
Ce blog examine le paysage réglementaire actuel des compléments à base de plantes, explore les plantes médicinales qui sont à risque et fournit des stratégies concrètes pour maintenir la conformité dans un marché mondial de plus en plus complexe.
L'essentiel
- L’Europe impose des interdictions et des restrictions sur les compléments à base de plantes comme l’ashwagandha, le kratom et les extraits de thé vert en raison de problèmes de sécurité.
- Les entreprises de compléments alimentaires sont confrontées à des rappels de produits, à des coûts de reformulation et à des défis de conformité complexes sur différents marchés.
- Les experts du secteur soulignent la nécessité d’une veille réglementaire proactive, de formulations diversifiées et d’une documentation de sécurité solide pour rester conforme.
Table des matières
- Quels compléments à base de plantes font l’objet d’une surveillance accrue et pourquoi ?
- Le cas de l'Ashwagandha : la réponse fragmentée de l'Europe
- Comment ces interdictions affectent les entreprises de compléments alimentaires
- Quelles mesures pouvez-vous prendre pour rester conforme ?
- À quoi s'attendre au-delà de 2025
- Comment RegASK aide à naviguer dans la complexité réglementaire mondiale
Quels compléments à base de plantes font l’objet d’une surveillance accrue et pourquoi ?
L'industrie des compléments alimentaires à base de plantes fait face à une pression réglementaire sans précédent, les autorités du monde entier intensifiant la surveillance des produits susceptibles de présenter des risques pour la sécurité. Cette surveillance couvre de multiples problématiques, des plantes médicinales traditionnelles aux produits contaminés par des ingrédients pharmaceutiques non déclarés. Comprendre quels compléments alimentaires font l'objet d'un examen réglementaire est crucial pour les fabricants, les distributeurs et les consommateurs qui évoluent dans ce contexte en constante évolution.
1. Plantes faisant l'objet d'un examen réglementaire dans l'UE
Dans l’UE, plusieurs plantes médicinales sont en cours d’examen pour leur classification, leur sécurité et leur utilisation autorisée dans les compléments alimentaires :
- Ashwagandha (Withania somnifera)
- Mélatonine
- Kratom (Mitragyna speciosa)
- Certains produits de la médecine traditionnelle chinoise (MTC)
2. Les compléments alimentaires pour la ménopause sous l'angle réglementaire
De nombreuses femmes se tournent vers les compléments alimentaires à base de plantes pour gérer les symptômes de la ménopause. Les ingrédients suivants, sous surveillance, sont fréquemment présents dans ces compléments :
- Baie de gattilier (Vitex agnus-castus)
- Trèfle rouge (Trifolium pratense)
- Actée à grappes noires (Actaea racemosa)
- Dong quai (Angelica sinensis)
- Maca (Lepidium meyenii)
Les experts ont exprimé des inquiétudes quant à leur sécurité, leur efficacité, leur potentiel de dommages au foie et leurs interactions négatives avec d’autres médicaments.. En conséquence, jeaugmenté On s’attend à une surveillance réglementaire accrue et à un scepticisme croissant des consommateurs à l’égard de ces produits.
3. Suppléments contenant des ingrédients interdits
Les autorités de régulation, telles que la Autorité des sciences de la santé de Singapour (HSA)), Administration américaine des aliments et des médicaments (FDA) et Santé Canada, ont émis plusieurs avis sur les compléments alimentaires à base de plantes et de santé contenant des ingrédients non déclarés ou interdits, notamment : [2] [3]
- Stéroïdes (par exemple, dexaméthasone, prednisolone)
- Sibutramine (médicament de perte de poids interdit)
- Inhibiteurs de la phosphodiestérase de type 5 (PDE-5) (par exemple, sildénafil, tadalafil)
- Diclofénac
- Hydroquinone
- Fluoxétine
- Prastérone (DHEA)
- Méthocarbamol
- Lidocaïne
- Phénolphtaléine
- Sennosides
Ces ingrédients ont été associés à des effets indésirables graves, notamment des événements cardiovasculaires, des lésions hépatiques, des troubles rénaux et d'autres risques pour la santé. Les produits contenant ces substances font l'objet de rappels, d'interdictions et de mesures d'application de la loi. Ces produits présentent des risques importants pour la santé en raison d'ingrédients non divulgués et d'interactions médicamenteuses potentielles.
4. Suppléments frelatés avec Non déclaré Médicaments
Les régulateurs mondiaux sévissent contre les compléments alimentaires contenant des ingrédients pharmaceutiques non déclarés, qui sont souvent déguisés en produits « naturels » destinés à améliorer la performance sexuelle, à perdre du poids ou à donner de l’énergie. Ministère israélien de la Santé a émis des avertissements concernant des substances cachées telles que sildénafil, tadalafil, et lévodopa, qui peuvent entraîner de graves risques pour la santé lorsqu’ils sont pris sans le savoir.
5. Suppléments contaminés et contrefaits
Au-delà des médicaments cachés, des suppléments contaminés par métaux lourds, toxines microbiennes, ou vendus comme contrefaçons demeurent une préoccupation mondiale majeure. Les autorités réglementaires renforcent les tests de produits et les contrôles à l'importation afin de protéger les consommateurs et de sanctionner les marques non conformes.
Le cas de l'Ashwagandha : la réponse fragmentée de l'Europe
L'ashwagandha (Withania somnifera) est devenu l'une des plantes médicinales les plus controversées sur le marché européen des compléments alimentaires. Porté par l'intérêt des consommateurs pour la réduction du stress et la santé naturelle, le marché européen de l'ashwagandha a connu une forte croissance de 10,91 TP18T entre 2019 et 2022, avec une croissance continue à deux chiffres prévue jusqu'en 2030. [5]
Pourquoi l'Ashwagandha est devenue une cible réglementaire
La popularité de l’Ashwagandha s’est avérée être sa chute. Alors que des millions de personnes se tournaient vers l'ashwagandha pour soulager le stress et gérer l'anxiété, les organismes de réglementation se sont inquiétés de son profil chimique complexe. Contrairement aux médicaments monomoléculaires, l'extrait de racine d'ashwagandha contient des dizaines de composés actifs, dont des withanolides, ce qui complique l'évaluation de sa sécurité. Le point de bascule réglementaire est survenu lorsque des rapports d'effets indésirables ont été signalés, notamment des cas de toxicité hépatique. Bien que la plupart des cas concernaient des produits contaminés ou des doses extrêmes, le mal était fait et les autorités réglementaires européennes sont passées à l'action.
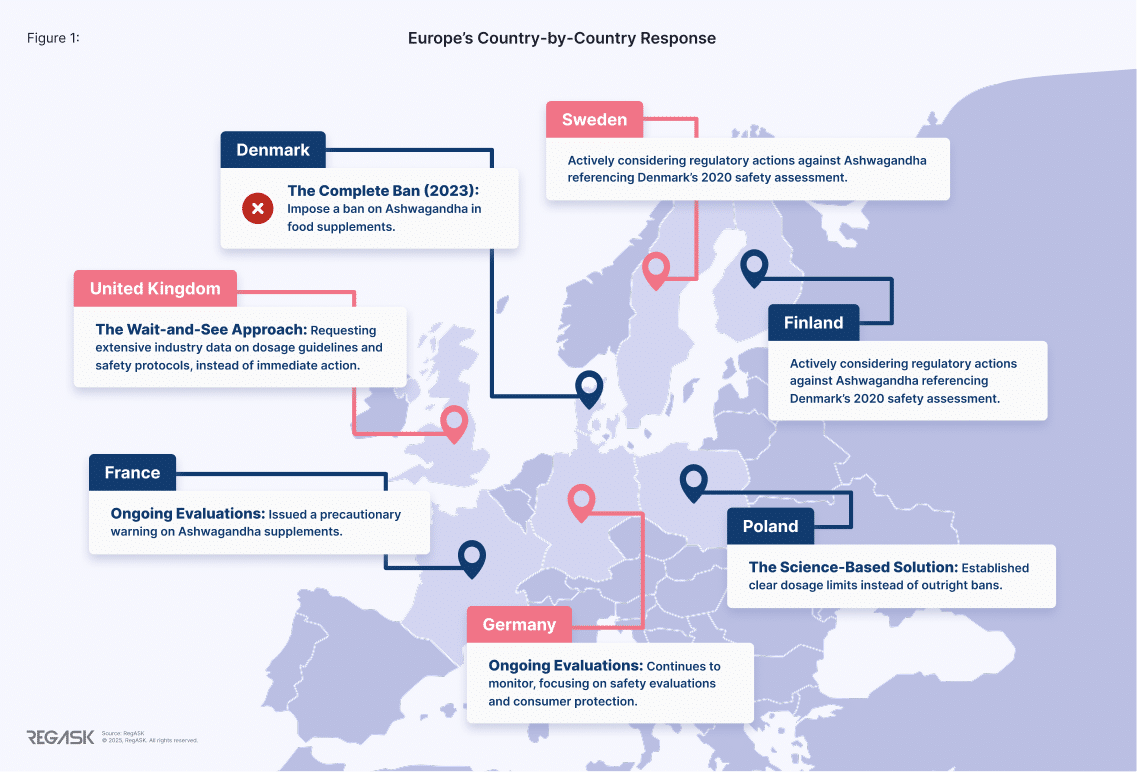
Réponses pays par pays de l'Europeet
Danemark : L'interdiction totale (2023)
Le Danemark est devenu le premier pays de l'UE à interdire l'ashwagandha dans les compléments alimentaires, à la suite d'une évaluation des risques réalisée en 2020 par l'Université technique du Danemark (DTU) qui a soulevé des inquiétudes concernant les perturbations hormonales et les risques potentiels pour la reproduction. [6] [7]
L'Administration vétérinaire et alimentaire danoise (DVFA) a rapidement appliqué l'interdiction, exigeant le retrait des produits du marché. Cette décision a eu un impact majeur sur les fabricants de compléments alimentaires opérant dans la région nordique, notamment auprès des groupes industriels. signaler des pertes financières importantes.[8]
Royaume-Uni : l'attentisme
L'Agence britannique des normes alimentaires a préféré procéder à un examen approfondi plutôt qu'à une action immédiate, exigeant des données industrielles complètes sur les recommandations de dosage et les protocoles de sécurité. Bien que plus mesurée, cette approche a créé un vide réglementaire pour les fabricants, qui n'ont pas pu prendre de décisions à long terme.
Pologne : la solution fondée sur la science
La Pologne a établi des limites de dosage claires au lieu d’interdictions pures et simples :
- Poudre de racine d'Ashwagandha : Maximum 3 g par jour [9]
- Extraits standardisés : Maximum 10 mg par jour [10]
Alliance nordique : Suède et Finlande
La Suède et la Finlande envisagent activement des mesures réglementaires contre l'ashwagandha, se référant principalement à l'évaluation de sécurité du Danemark réalisée en 2020 par l'Université technique du Danemark (DTU) comme justification.
France et Allemagne : évaluations en cours [11] [12]
En 2024, l'Agence française de sécurité sanitaire des aliments (ANSES) a émis un avertissement concernant les compléments alimentaires à base d'ashwagandha, conseillant aux groupes vulnérables – notamment les femmes enceintes ou allaitantes, les mineurs et les personnes souffrant de problèmes de thyroïde, de foie ou de cœur – d'éviter leur utilisation en raison des effets indésirables signalés et du manque de données de sécurité. Cette mesure a conduit à un renforcement des exigences d'étiquetage et à un renforcement de la surveillance réglementaire sur le marché français des compléments alimentaires.
Pendant ce temps, l'Allemagne continue de surveiller les compléments alimentaires à base de plantes comme l'ashwagandha dans le cadre de son Institut fédéral d'évaluation des risques (BfR), en se concentrant sur les évaluations de sécurité et la protection des consommateurs, bien qu'aucune interdiction formelle n'ait été promulguée.
Comment ces interdictions affectent les entreprises de compléments alimentaires
Impact financier sur l'ensemble de la chaîne d'approvisionnement
L'incertitude réglementaire entourant l'ashwagandha a perturbé la chaîne d'approvisionnement à plusieurs niveaux. Les fournisseurs de matières premières ont été confrontés à une forte baisse des commandes, notamment sur les marchés soumis à des restrictions.
Les fabricants sous contrat ont été contraints de reformuler leurs produits, entraînant souvent des coûts élevés pour trouver des alternatives, revalider les formules et mettre à jour les étiquettes. Dans certains cas, les entreprises ont dû gérer des rappels de produits ou des ruptures de stock dues à l'arrêt de la distribution. Ces défis soulignent l'importance cruciale pour les entreprises de surveiller attentivement l'environnement réglementaire et d'élaborer des stratégies prospectives afin de garantir la continuité des activités et de minimiser les risques financiers. [6] [7] [9]
Le cauchemar de la conformité
La gestion de la réglementation de l'ashwagandha sur les multiples marchés européens est devenue un défi permanent pour les fabricants de compléments alimentaires. Les entreprises ont désormais souvent besoin de formulations et d'étiquetages différents. D'après NutraIngredients. [10]Les leaders de l’industrie décrivent la complexité de la navigation dans des réglementations nationales divergentes comme « un cauchemar logistique », certaines entreprises étant obligées de gérer plusieurs versions de produits pour différents marchés.
Un responsable des affaires réglementaires d'une grande entreprise de compléments alimentaires explique : « Nous sommes passés de la gestion d'une seule formule européenne à la gestion de huit versions différentes. La complexité à elle seule a failli mettre à mal notre équipe opérationnelle. »
(Entretien avec l'industrie, 2025)
Confiance dans la marque et confusion des consommateurs
Le plus dommageable a peut-être été l'impact sur la confiance des consommateurs. Les consommateurs habitués à acheter de l'ashwagandha en ligne se sont soudainement retrouvés confrontés à des informations contradictoires sur sa sécurité. Les réseaux sociaux étaient envahis de clients perplexes se demandant : « L'ashwagandha est-il sans danger ? » et « Pourquoi l'ashwagandha est-il interdit ? »
Les entreprises ont investi massivement dans la sensibilisation des consommateurs, expliquant la différence entre un extrait d'ashwagandha standardisé de qualité et des produits potentiellement problématiques. Les entreprises proposant des produits à base d'ashwagandha certifiés USP et NSF se sont dotées d'un avantage concurrentiel.
Quelles mesures pouvez-vous prendre pour rester conforme ?
1. Créer une documentation à toute épreuve : guides RegASK
Dans un contexte de surveillance réglementaire accrue, la documentation n'est pas une simple formalité ; c'est votre première ligne de défense. Les entreprises les plus résilientes vont au-delà de la compilation d'études existantes ; elles élaborent des dossiers stratégiques qui anticipent les préoccupations réglementaires.
Guides RegASK Valide avec expertise les packages de sécurité et de conformité conçus pour répondre aux normes mondiales. Qu'il s'agisse de risques toxicologiques, de seuils de dosage ou de restrictions d'utilisation, ces guides sont conçus pour anticiper les objections, et non pour y réagir.
2. Tirer parti des renseignements réglementaires proactifs
Attendre qu'une interdiction soit publiée dans une publication spécialisée n'est plus une stratégie viable. Les entreprises qui ont su garder une longueur d'avance ont utilisé Intelligence réglementaire pilotée par l'IA pour surveiller en temps réel les risques mondiaux émergents.
L'utilisation de solutions comme RegASK permet d'identifier les changements d'opinion réglementaire avant la mise en place de restrictions formelles. Cela donne le temps d'étudier les ajustements de formulation et d'étiquetage, de réorienter les stratégies de marché ou de contacter les autorités réglementaires en amont. Cette anticipation aide les entreprises à maintenir leur accès aux marchés clés et à saisir les opportunités dans les régions où le contexte réglementaire est plus favorable.
Être proactif ne garantit pas seulement la conformité ; cela débloque avantages de timing compétitifs dans des environnements réglementaires de plus en plus fragmentés.
3. Adopter des stratégies de diversification des ingrédients
Se fier excessivement à un seul ingrédient phare peut rapidement devenir un handicap. Lorsque des ingrédients comme l'ashwagandha ont été interdits ou soumis à des limitations de dosage strictes, les entreprises ayant diversifié leurs formules ont pu s'adapter, tandis que les marques mono-ingrédients ont dû faire face à des difficultés.
Des équipes tournées vers l’avenir mélangent l’ashwagandha avec de la rhodiola, du magnésium ou d’autres adaptogènes pour développer des formulations qui sont non seulement efficaces mais également résilientes à la réglementation. Les renseignements réglementaires de RegASK peuvent vous guider dans l'identification d'alternatives d'ingrédients conformes adapté à votre marché et à votre catégorie.
La diversification des ingrédients n’est pas seulement un filet de sécurité ; c’est une stratégie d’innovation de produit alimentée par une prévoyance réglementaire.
À quoi s'attendre au-delà de 2025
Alors que la surveillance mondiale autour des compléments alimentaires à base de plantes s'intensifie, les entreprises doivent se préparer à un avenir réglementaire plus structuré et axé sur les données. Trois tendances clés définiront le paysage post-2025.
L’harmonisation mondiale s’accélère. Bien que la réglementation botanique reste aujourd’hui fragmentée, des initiatives comme la Stratégie de l'OMS en matière de médecine traditionnelle [13] Cela marque une évolution vers des normes de sécurité unifiées. Pour les marques mondiales, la complexité à court terme persiste, mais la voie vers une conformité simplifiée se dessine.
La conformité pilotée par l’IA devient la norme du secteur. Les équipes réglementaires modernes se tournent vers des solutions telles que RegASK pour anticiper les changements, cartographier les risques liés aux ingrédients et rationaliser les flux de travail afin d'aider à éliminer les conjectures de la conformité mondiale.
Des allégations fondées sur des preuves sont requises. Les autorités renforcent les restrictions sur les allégations de santé non fondées. Leur succès dépendra de la validation clinique, de la transparence et de la capacité à s'adapter rapidement aux nouvelles exigences de justification des allégations. comprendre les réglementations et les processus locaux.
À l'avenir, la conformité ne consiste pas seulement à suivre le rythme ; il s'agit de garder une longueur d'avance. Les gagnants seront ceux qui feront de l'agilité réglementaire une stratégie commerciale essentielle.
Comment RegASK aide à naviguer Complexité réglementaire mondiale
RegASK simplifie la prise de décision réglementaire grâce à une solution basée sur l'IA qui fournit des informations actualisées, une documentation intelligente et une orchestration des flux de travail. De l'identification des facteurs de risque à la gestion de la conformité interrégionale, RegASK permet aux équipes réglementaires d'agir plus rapidement, d'atténuer les risques en temps opportun et d'anticiper les changements, à l'échelle mondiale et à grande échelle.
Prêt à pérenniser votre stratégie de conformité ? Réserver une démo pour voir comment RegASK peut vous aider à naviguer en toute confiance dans la complexité réglementaire.
Foire aux questions (FAQ)
- Pourquoi le Danemark a-t-il interdit l’Ashwagandha ? Le Danemark a interdit l'ashwagandha en 2023 après qu'une évaluation des risques a mis en évidence un potentiel trouble hormonal et des risques pour la reproduction. L'Administration vétérinaire et alimentaire danoise a exigé le retrait du marché de tous les produits contenant de l'ashwagandha afin de protéger la santé publique.
- Quels autres compléments à base de plantes font l’objet d’une surveillance accrue en Europe ? Outre l'ashwagandha, plusieurs compléments alimentaires à base de plantes font l'objet d'un examen réglementaire en Europe, notamment le kratom, les extraits de thé vert, les baies de gattilier, le trèfle rouge, l'actée à grappes noires et le Dong Quai. Les autorités évaluent leur innocuité, leur toxicité hépatique potentielle et leur potentiel anti-inflammatoire. interactions possibles avec des médicaments, ce qui peut conduire à des réglementations plus strictes ou à des interdictions.
- Comment ces interdictions affectent-elles les entreprises mondiales de compléments alimentaires ? Les interdictions mondiales engendrent des défis opérationnels majeurs, notamment des rappels de produits, des coûts de reformulation, des exigences de conformité spécifiques à chaque pays et une perte de confiance des consommateurs. De nombreuses entreprises adoptent des plateformes de veille réglementaire pour surveiller et gérer proactivement ces risques.
- Comment les entreprises peuvent-elles se prémunir contre l’évolution de la réglementation sur les compléments alimentaires à base de plantes ? Les entreprises devraient investir dans une documentation complète sur la sécurité, une veille réglementaire basée sur l'IA, des portefeuilles d'ingrédients diversifiés et des recherches cliniques fondées sur des données probantes. Des plateformes comme RegASK aider les entreprises à anticiper les changements réglementaires et à maintenir l’accès au marché à l’échelle mondiale.
Références et citations
- sciencedirect.com – Adaptogène
- hsa.gov.sg – Mises à jour de la HSA sur les produits trouvés à l'étranger et contenant des ingrédients puissants (mars 2025)
- hsa.gov.sg – Alerte HSA : Quatre produits contiennent des ingrédients médicinaux puissants, dont des stéroïdes et une substance interdite ; quatre consommateurs ont ressenti des effets indésirables après avoir consommé trois de ces produits.
- gov.il – Produits « naturels » contrefaits
- kbvresearch.com – Marché européen de l'extrait d'ashwagandha
- pmc.ncbi.nlm.nih.gov – Interdiction danoise de l'Ashwagandha : vérité, preuves, éthique et réglementation
- mcgill.ca – Pourquoi le Danemark a-t-il interdit l’Ashwagandha ?
- olemiss.edu – ashwagandha-khan-chittiboyina
- vitafoodsinsights.com – Mise à jour réglementaire de l'UE sur l'ashwagandha
- nutraingredients.com – Inquiétudes croissantes concernant la sécurité de l'ashwagandha dans les États membres de l'UE
- foodcomplianceinternational – La France émet un avis sur les effets indésirables potentiels de l'Ashwagandha
- .bfr.bund.de – Ashwagandha : des compléments alimentaires potentiellement dangereux pour la santé
- mtci.bvsalud.org – L'OMS organise le premier sommet mondial de haut niveau sur la médecine traditionnelle afin d'explorer les données probantes et les possibilités d'améliorer la santé pour tous.