Der TGA Die empfohlene maximale Tagesdosis an Vitamin B6 in gelisteten (risikoarmen) Arzneimitteln wie Komplementärmedizin wird geändert. Derzeit ist die Verwendung von Vitamin B6 in Humanarzneimitteln auf Arzneimittel der Liste 4 (verschreibungspflichtig) beschränkt, mit Ausnahme von:
- In oralen Zubereitungen, die 200 mg oder weniger, aber mehr als 50 mg Pyridoxin, Pyridoxal oder Pyridoxamin pro empfohlener Tagesdosis enthalten, sofern sie den Anforderungen der Required Advisory Statements for Medicine Labels (RASML*) entsprechen; oder
- In oralen Zubereitungen, die 50 mg oder weniger Pyridoxin, Pyridoxal oder Pyridoxamin pro empfohlener Tagesdosis enthalten.
*Hinweis: Das RASML verlangt den Hinweis (VITB6SX) auf dem Etikett: „WARNUNG – Beenden Sie die Einnahme dieses Medikaments, wenn Sie Kribbeln, Brennen oder Taubheitsgefühle verspüren, und suchen Sie so schnell wie möglich Ihren Arzt auf. [Enthält Vitamin B6].“ Zur Klarstellung: Produkte, die 50 mg oder weniger pro empfohlener Tagesdosis enthalten, benötigen keinen Warnhinweis auf dem Etikett.
Nach einer Überprüfung der Nebenwirkungen im Zusammenhang mit der langfristigen Einnahme von Vitamin-B6-Ergänzungsmitteln und auf Grundlage der Nährstoffreferenzwerte für Vitamin B6 in Australien und Neuseeland, die für Erwachsene auf 50 mg Pyridoxin/Tag und für Säuglinge deutlich niedriger festgelegt sind, hat die TGA beschlossen, die Einträge in der Bestimmung der zulässigen Inhaltsstoffe wie folgt zu ändern:
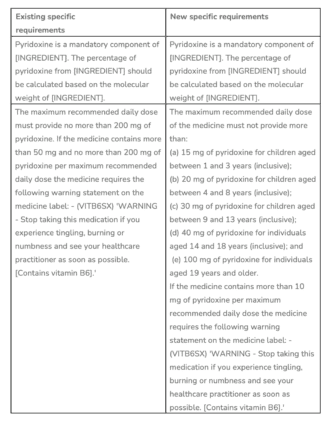
„INHALTSSTOFF“ = Pyridoxal-5-phosphat, Pyridoxal-5-phosphat-Monohydrat, Pyridoxinhydrochlorid. Dies sind die zugelassenen Formen für die aufgeführten Arzneimittel.
Die endgültigen Änderungen treten am 1. März 2022 in Kraft, wobei eine einjährige Übergangsfrist gilt, die es den Sponsoren (MA-Inhabern) ermöglicht, die Produktkonformität sicherzustellen. Diese endet am 1. März 2023.
Kontaktieren Sie RegASK, um mehr über Regulierungsänderungen in Australien zu erfahren.
Kontaktieren Sie RegASK für weitere Details Mehr lesen
